

Одним із важливих кроків України на шляху до євроінтеграції має стати впровадження національної системи верифікації лікарських засобів з метою імплементації європейської практики запобігання обігу фальсифікованих препаратів.
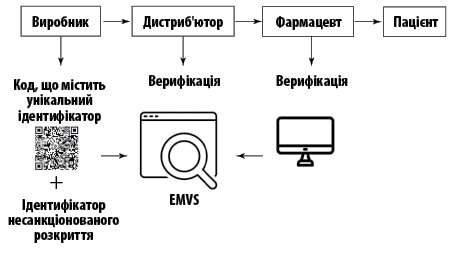
Гарантувати автентичність препаратів, що потрапляють в легальний ланцюг постачання, має Європейська система перевірки лікарських засобів (European Medicines Verification System — EMVS). Лікарські засоби, що відпускаються за рецептом, і деякі безрецептурні препарати повинні мати безпекові елементи — унікальний ідентифікатор та ідентифікатор несанкціонованого розкриття упаковки. Зазначені вимоги застосовуються на додаток до звичайних вимог до маркування.На жаль, феномен фальсифікації й поширення підроблених лікарських засобів зростає, все більше препаратів потрапляють у зону ризику. До них належать дороговартісні ліки, а також препарати, які користуються високим попитом
Унікальний ідентифікатор являє собою двовимірний код (QR-код), в якому має бути закодовано такі дані: код продукту, серійний номер, номер партії та термін придатності.
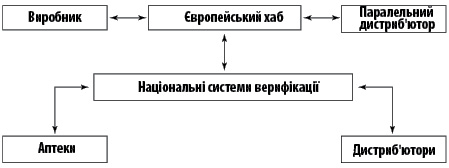
Власник реєстраційного посвідчення завантажує дані про препарат в Європейський хаб (EU Hub), який адмініструє Європейська організація з верифікації лікарських засобів (European Medicines Verification Organisation — EMVO). Дистриб’ютор або фармацевт мають можливість перевірити дані про лікарський засіб через національні системи верифікації, відсканувавши унікальний код. Фармацевт зобов’язаний перед відпуском препарату пацієнтові перевірити упаковку та підтвердити її автентичність (рис. 1).Рис. 1. Рух лікарського засобу
Правовою основою для цієї системи є Директива щодо фальсифікованих лікарських засобів 2011/62/ЕС та Делегований регламент Комісії (ЄС) 2016/161, що доповнює Директиву шляхом встановлення детальних правил щодо ознак безпеки, які мають міститися на упаковці. Правила набули чинності 9 лютого 2019 р.
Дія цих документів поширюється, як правило, на всі препарати, що відпускаються за рецептом, за деякими винятками, зазначеними в Делегованому регламенті Комісії (ЄС) 2016/161. Лікарські засоби, що відпускаються без рецепта, переважно не входять до сфери застосування зазначених правил, однак є декілька винятків. Окрім того, національні компетентні органи можуть адаптувати перелік лікарських засобів, на які поширюються правила, якщо вони вважають, що є високий ризик фальсифікації.
До 9 лютого 2019 р. кожна країна ЄС мала запровадити національну систему верифікації лікарських засобів та підключити її до Європейського хабу. За її створення та управління відповідає національна організація верифікації лікарських засобів. До EMVS підключено всі країни — члени ЄС та декілька країн, які є членами Європейської економічної зони.
Національна система верифікації лікарських засобів служить платформою, яку дистриб’ютор, лікар або фармацевт можуть використовувати для ідентифікації та перевірки автентичності препарату (рис. 2).Рис. 2. Європейська система верифікації лікарських засобів
У системі EMVS є декілька термінів, які варто розібрати.
Подія (event) — те, що відбувається в процесі верифікації і становить інтерес. Якщо система фіксує таку подію, створюється аудиторський слід, за яким її можна дослідити або проаналізувати. Деякі події являють собою винятки (exceptions) — це події, які порушують нормальний хід процесу. Дані про зареєстровані події передаються через сповіщення (notifications) одному або декільком одержувачам електронною поштою або через API. Якщо виняток є критичним, піднімається тривога, сповіщення містить ідентифікатор попередження (alert).
Система виконує наступні перевірки унікального ідентифікатора:
Національна система може оголосити попередження, якщо будь-який із цих трьох тестів провалиться. Існує 7 типів винятків, які становлять загрозу того, що упаковка фальсифікована. Їх можна згрупувати у 3 категорії.Національна система верифікації лікарських засобів служить платформою, яку дистриб’ютор, лікар або фармацевт можуть використовувати для ідентифікації та перевірки автентичності препарату
Перша об’єднує проблеми з ідентифікацією упаковки: не знайдено номер партії (немає даних про партію, вказано неправильний номер партії, номер партії не завантажено в Європейський хаб, на упаковці закодовано неправильний номер партії), упаковку не знайдено (вказано неправильний серійний номер, в системі немає даних про упаковку), невідповідність номера партії зареєстрованим даним, невідповідність терміну придатності зареєстрованим даним. Можливі причини — виробник не завантажив дані до Європейського хабу; дані неправильно представлені у двовимірному коді/код надруковано неправильно; у програмному забезпеченні клієнта (аптеки або дистриб’ютора) сталася помилка або сканер не працює правильно; дані, які вводяться вручну, введено неправильно; продукт фальсифіковано.
Друга група винятків стосується статусу упаковки: спроба повторно змінити статус упаковки, статус упаковки не вдалося змінити. Це означає, що була спроба змінити статус упаковки, в той час як вона вже знаходиться у цьому статусі. Якщо системі здається це підозрілим, вона може видати попередження. Наприклад, кінцевий користувач намагається позначити, що упаковка поставлена, в той час як вона вже була зафіксована як поставлена в іншому місці. Або надійшло декілька запитів на позначення однієї й тієї самої упаковки як поставленої в одному місці.
Третя група пов’язана із дублюванням серійного номера. Це попередження вказує на те, що 2 або більше упаковок мають ідентичний код продукту і серійний номер.
Якщо у фармацевта або дистриб’ютора є будь-які підстави вважати, що упаковка була фальсифікована, вони не повинні відпускати або надавати препарат на продаж та мають негайно повідомити відповідні компетентні органи.
Серйозність проблеми визначається за 5-рівневою шкалою. Рівень 1-й — виняток, який система здатна обробити самостійно і не потребує надсилання сповіщення. Рівень 2-й — система інформує про виняток ініціатора транзакції (фармацевта або дистриб’ютора). Рівень 3-й — система повідомляє про виняток системного адміністратора. Це, як правило, уповноважений працівник національної організації верифікації лікарських засобів, який відповідає за моніторинг попереджень. Рівень 4-й — сповіщення отримує не тільки національна, а й Європейська організація з верифікації лікарських засобів. Рівень 5-й передбачає, що сповіщення передається і власнику реєстраційного посвідчення через Європейський хаб (рис. 3).Рис. 3. Система сповіщень та повідомлень

Якщо у фармацевта або дистриб’ютора є будь-які підстави вважати, що упаковка була фальсифікована, вони не повинні відпускати або надавати препарат на продаж та мають негайно повідомити відповідні компетентні органи
Усі винятки реєструються в системі, де вони виникають. Є правила стосовно того, які винятки мають передаватися далі до Європейського хабу (рівень 4-й). Коли Європейський хаб отримує сповіщення, він теж його реєструє. Служба сповіщення про винятки може потім підвищити його рівень (до 5-го) відповідно до своїх правил. Коли попередження отримує національна система верифікації (рівень 3-й), сповіщення про це передається в межах національної організації верифікації лікарських засобів відповідному персоналу.
За даними EMVO, фіксується близько 8 млн сканувань щомісяця. На них припадає близько 800–1500 попереджень на тиждень. Щомісячна частота сповіщень має тенденцію до зниження, і в квітні 2023 р. досягла позначки 0,14%. Більшість попереджень стосується невідповідності номера партії або неправильного/невідомого номера партії.
Фальсифіковані лікарські засоби — одна з найсерйозніших проблем охорони здоров’я, що зачіпає не окремі країни, а має світовий масштаб. Це підроблені ліки, які видають себе за справжні, тобто дозволені до застосування та зареєстровані відповідним регуляторним органом. Однак фальсифіковані ліки не проходять звичайну оцінку якості, безпеки та ефективності, необхідну для процедури авторизації на ринку. А відтак — можуть становити загрозу для здоров’я. Вони можуть містити неякісні інгредієнти або неправильні дози, бути навмисно та шахрайським шляхом неправильно промарковані щодо їх ідентичності чи джерела походження, мати підроблену упаковку.
Фальсифіковані ліки — це не те саме, що контрафактні. Фальсифіковані — це підроблені ліки, які імітують справжні. Контрафактні — не відповідають правам інтелектуальної власності або порушують закон про товарні знаки.
Донедавна найбільш часто фальсифікованими ліками в країнах з високим рівнем доходу були дороговартісні препарати, які впливають на стиль життя, зокрема гормональні, стероїдні, антигістамінні препарати. У країнах, що розвиваються, найчастіше фальсифікують препарати, призначені для лікування небезпечних для життя хвороб — ВІЛ/СНІД, туберкульоз, малярія тощо.
На жаль, феномен фальсифікації й поширення підроблених лікарських засобів зростає, все більше препаратів потрапляють у зону ризику. До них належать дороговартісні ліки, наприклад ті, що застосовуються для лікування онкологічних захворювань, а також препарати, які користуються високим попитом, наприклад противірусні засоби.Гарантувати автентичність препаратів, що потрапляють в легальний ланцюг постачання, має Європейська система перевірки лікарських засобів
Законодавча база ЄС, спрямована на запобігання збуту фальсифікованих ліків та потраплянню їх до кінцевого споживача (пацієнта), містить правила і вимоги по всьому ланцюгу руху упаковки препарату до кінцевого споживача. Директива 2011/62/ЕС передбачила нові безпекові вимоги до виробника у вигляді маркування упаковки унікальним ідентифікатором та ідентифікатором несанкціонованого розкриття; нові вимоги до дистриб’ютора (оновлення настанов щодо Належної дистриб’юторської практики (2013)); нові вимоги до ввезення активних фармацевтичних інгредієнтів (з липня 2013 р. всі діючі речовини, вироблені за межами ЄС та імпортовані в ЄС, повинні супроводжуватися письмовим підтвердженням від регуляторного органу країни-експортера); вимоги до інтернет-аптек. Запроваджено обов’язковий логотип, який дає змогу споживачам ідентифікувати інтернет-аптеки, які реалізовують лікарські засоби на законній основі. Натиснувши на логотип, споживач перейде на вебсайт національного регуляторного органу, де вказано перелік всіх законно працюючих інтернет-аптек у конкретній країні.
Джерело: Щотижневик «Аптека»
.